当前位置: 得创净化(湖北)有限公司 > 净化工程 > 技术支持 > 相关标准 >
医疗器械GMP建设流程及现场核查内容
发布时间:2022-05-06 10:01 人气: 来源:http://wccj.deiiang.com
医疗器械GMP的目地是因为提高医疗器械生产监视治理,规范医疗器械生产品质治理系统软件,凭据《医疗器械监视治理规章》和有关例律划分,自2011年1月1日起宣布实行,2011年7月1日后达不上规范的公司将不允许申请注册。
GMP”是英语Good Manufacturing Practice 的简称, Good 中文的意思是“优异作业规范 优越作业规范”,或者“优质生产制造 优异作业规范 优质生产制造 限度”,是一种新奇重视在生产过程中推行确保产 品限度 品质安全的治理规章制度。
一. 建立医疗器械GMP洁净室(下称GMP)过程中的普遍错误观念及精确防范措施
关键点 |
普遍错误观念 |
精确防范措施 |
系统软件建立机会 |
物质开发设计前 |
|
系统软件用心人 |
系统软件运营专员 |
最大治理者 |
系统软件干预员工 |
系统软件运营专员承担全部责任 |
全体人员干预 |
安装文件建立 |
朴素套入别人模板 |
文档应适宜、详细、有用,与产物相切合,争取精炼 |
追溯性操纵 |
单位中间追溯性信息未统一,品质记录没法满足追溯性规定 |
保证产物、原材料的生产批号、数量、日期等信息的一致性 |
例律根据 |
仅根据YY/T 0287-2003 |
GMP YY/T 0287-2003 |
系统确立运行 |
由无系统运行履历的员工核心系统确立、运行 |
找寻有履历的指点组织帮助学习培训确立系统 |
二. 医疗设备洁净室GMP当场审查过程中疑难问题
编号 |
疑难问题 |
結果 |
1 |
系统文档与产物特点、GMP规定纷歧致 |
系统无有效性,没法具体指导质量管理历程。 |
2 |
系统文档过度巨大,品质纪录信息冗余大 |
系统无适宜性,公司把大量的時间用以品质纪录的填好审批,系统认同度低。 |
3 |
历程竣事后补纪录 |
未在设计方案设计阶段就运作品质整治系统,造成在外界审批前填补历程纪录,系统运作不丰富。 |
4 |
产物、原材料名字、型号规格、生产批号、日期等信息不统一 |
因产物和原材料信息不断调节,造成产物追朔纪录不断改动,系统没法迅速运作。 |
5 |
职员未干预系统的推行过程 |
系统涉及到的单位职员因事儿较忙不可以真真正正干预到系统的学习培训和运行过程,致系统没法有效运行,公司无法根据审批。 |
6 |
最大治理者不高度重视系统运行 |
没法得到系统运行必须的資源,各单位相互配合度低,系统无法运行。 |
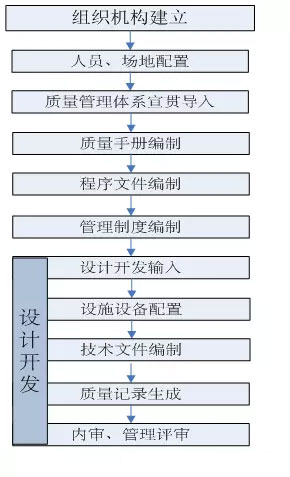
三.医疗器械GMP标准洁净室建立的精确流程
相关产品
相关新闻
- 万级镀膜无尘室装修施工 2023-03-31
- 药品无尘厂房装修注意事项 2023-03-31
- 千级光伏洁净厂房设计装修 2023-03-30
- 饮料净化车间设计标准 2023-03-30
- 制药无尘厂房装修材料 2022-11-10
- 十万级洁净车间造价 2022-11-10
- 饮用水无尘厂房设计规范 2022-11-10
- 万级无尘车间成本 2022-11-10
- 食品净化车间布局设计 2022-11-10
- 洁净车间风量如何检测 2022-11-10








 服务热线:1818-667-1616 027-82289886 彭经理
服务热线:1818-667-1616 027-82289886 彭经理
 地址:销售部地址:湖北省武汉市江岸区中一路华宇旭辉星空1栋1520室;工厂地址:湖北省东西湖区泾河三路
地址:销售部地址:湖北省武汉市江岸区中一路华宇旭辉星空1栋1520室;工厂地址:湖北省东西湖区泾河三路





 客服
客服